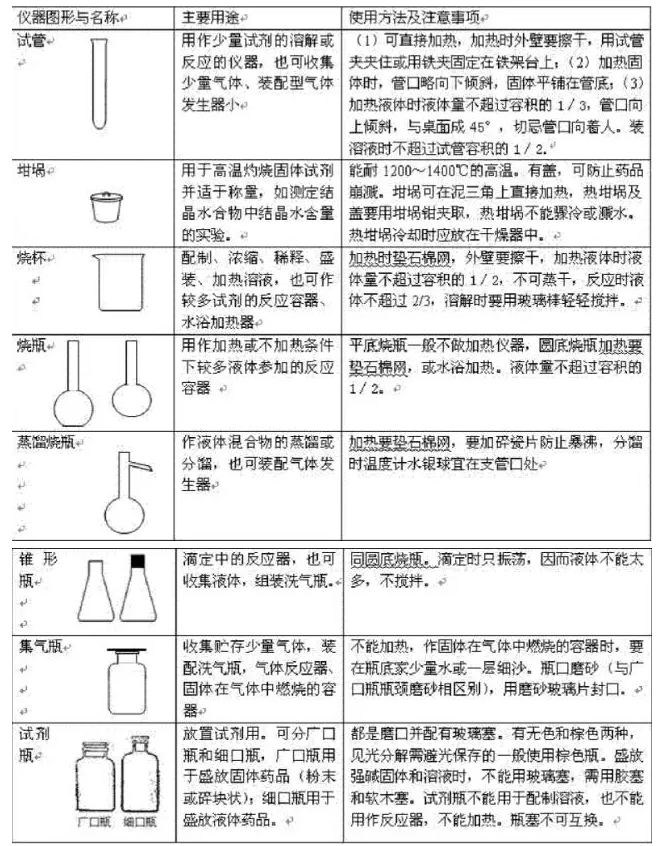
今天推荐给大伙高中化学离子方程式和离子化学反应规则,期望可以帮助大伙; 1、复分解型离子反应:例:Ag++Cl-=AgCl 2H++CO32- =CO2+H2O 2、置换反应型:例:Zn+2H+=Zn2++H2 Cl2+2I-=2Cl-+I2 3、盐类水解型:例:NH4++H2O==NH3H2O+H+ CH3COO-+H2O ==CH3COOH+0H- 4、复杂的氧化还原型:例:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O 另外还有生成物中有络合物时的离子反应等。 高中化学离子方程式书写规则: 1、只能将强电解质(指溶于水中的强电解质)写出离子形式,其它(包含难溶强电解质)一律写成分子形式。如碳酸钙与盐酸的反应:CaCO3+2H+=Ca2++CO2+H2O 因此熟记什么物质是强电解质、什么强电解质能溶于水是写好离子方程式的基础和重点。 2、不在水溶液中反应的离子反应,不可以书写离子方程式。如铜与浓H2SO4的反应,浓H2SO4与相应固体物质取HCI、HF、HNO3的反应,与Ca(OH)2与NH4Cl制取NH3的反应。 3、碱性氧化物虽然是强电解质,但它只可以用化学方程式写在离子方程式中。如CuO与盐酸的反应:CuO+2H+=Cu2++H2O 4、有酸式盐参加的离子反应,对于弱酸酸式根离子不可以拆成H+和酸根阴离子(HSO4-除外)。 如NaHCO3溶液和NaOH溶液混合:HCO3-+OH-=CO32-+H2O不可以写成:H++OH-=H2O 5、书写氧化还原反应的离子方程式时,第一写好参加反应的离子,然后确定氧化产物和还原产物,再用察看配平并补齐其它物质即可;书写盐类水解的离子方程式时,先写好发生水解的离子,然后确定产物,再配平并补足水分子即可。 6、需要遵守水平守恒和电荷守恒定律,即离子方程式不只要配平原子个数,还要配平离子电荷数和得失电子数。如在FeCl2溶液中通入Cl2,其离子方程式不可以写成: Fe2++Cl2=Fe3++2Cl-,因反应前后电荷不守恒,应写成:2Fe2++Cl2=Fe3++2Cl-。 7、不可以因约简离子方程式中局部系数而破坏整体的关系量。如稀H2SO4和Ba(OH)2溶液的反应,若写出为:Ba2++OH-+H++SO42-=BaSO4+H2O就是不对的,正确应为Ba2++2OH-+2H++SO42-=BaSO4+2H2O。